Генетика
-
Генетическая связь между леворукостью и неврологическими расстройствами
Новое исследование с использованием данных Британского биобанка раскрыло генетические корни леворукости, выявив редкие варианты гена бета-тубулина TUBB4B, значительно связанные с этой чертой. Эти результаты не только проливают свет на сложное взаимодействие между генетикой и асимметрией мозга, но также связывают леворукость с нарушениями нервного развития через общие генетические пути.
https://neurosciencenews.com/genetic-left-handed-neurology-25864/
-
Детальный анализ дорсально-вентральных градиентов экспрессии генов в гиппокампе взрослых крыс
Мы провели секвенирование РНК дорсальной и вентральной частей гиппокампа и сравнили его с ранее опубликованными данными, чтобы определить различия в дорсовентральных градиентах экспрессии генов, которые могут быть результатом биологической или технической изменчивости. Наши данные свидетельствуют о том, что дорсальная и вентральная части гиппокампа различаются по экспрессии генов, связанных с сигнальными путями, опосредованными классическими нейротрансмиттерами (глутамат, ГАМК, моноамины и др.), а также пептидами и лигандами Wnt. Эти части гиппокампа также расходятся по экспрессии молекул, направляющих аксоны (как рецепторов, так и лигандов), и изоформ сплайсинга генов, связанных с межклеточной передачей сигналов и клеточной адгезией. Более того, анализ дифференциальной экспрессии генов, специфичных для астроцитов, микроглии, олигодендроцитов и сосудистых клеток, позволяет предположить, что ненейрональные клетки также могут различаться по характеристикам между частями гиппокампа. Анализ экспрессии мобильных элементов показал, что истощение рибосомальной РНК сильно увеличивает представленность мобильных элементов в библиотеках РНК и помогает обнаружить слабое преобладание экспрессии этих элементов в вентральном гиппокампе. Наши данные выявили новые молекулярные измерения функциональных различий между дорсальным и вентральным гиппокампом и указывают на возможные каскады, которые могут быть вовлечены в продольную организацию гиппокампа.
-
Вклад ацетилирования гистонов в серотонин-опосредованную долговременную синаптическую пластичность у наземных улиток
Серотонин играет решающую роль в долговременной синаптической пластичности и долговременной памяти у моллюсков. Ранее мы продемонстрировали, что ацетилирование гистонов является регуляторным механизмом долговременной памяти у наземных улиток. На поведенческом уровне в Helix было проведено множество исследований, чтобы выяснить роль ацетилирования гистонов и серотонина. Однако влияние ацетилирования гистонов на долговременное потенцирование синаптической эффективности в электрофизиологических исследованиях у Helix было изучено только в одной статье. Здесь мы исследовали влияние серотонина, ингибиторов гистондеацетилаз бутирата натрия и трихостатина А, а также ингибитора серотонинергических рецепторов метиотепина на долговременное потенцирование синаптических ответов in vitro. Мы продемонстрировали, что метиотепин резко снижал амплитуды ВПСП при индуцировании долгосрочной потенциации, в то время как совместное применение ингибиторов гистондеацетилазы бутирата натрия или трихостатина А с метиотепином предотвращало ослабление потенциации. Мы показали, что однократное применение серотонина в сочетании с блокадой гистондеацетилазы может имитировать эффект повторных применений серотонина и быть достаточным для устойчивых долговременных синаптических изменений. Полученные данные продемонстрировали, что блокада деацетилаз гистонов устраняет дефицит синаптической пластичности, вызванный различными парадигмами (лечение метиотепином, слабый протокол тренировки с однократным применением серотонина), что позволяет предположить, что ацетилирование гистонов способствует серотонин-опосредованной синаптической пластичности.
-
Роль мобильных элементов генома человека в функции и патологии нейронов
Мобильные элементы (МЭ) интенсивно изучаются на протяжении десятилетий. В последние годы внедрение полногеномных и полнотранскриптомных подходов, а также методов разрешения отдельных клеток обеспечило прорыв, который открыл участие TE в регуляции экспрессии генов хозяина, лежащей в основе множества нормальных и патологических процессов. Особый интерес представляет повышенная активность ТЕ в нейрональной ткани, в частности в гиппокампе, неоднократно продемонстрированная в многочисленных экспериментах. С другой стороны, многочисленные нейропатологии связаны с нарушением регуляции TE. Здесь мы предоставляем всесторонний обзор литературы о роли TE в нейронах, опубликованной за последние три десятилетия. В первой главе настоящего обзора описаны известные механизмы взаимодействия ТЕ с геномами хозяина в целом, с акцентом на ТЕ млекопитающих и человека; во второй главе приведены примеры экзаптации ТЕ в нормальной нейрональной ткани, включая участие ТЕ в дифференцировке и пластичности нейронов; а в последней главе перечислены невропатологии, связанные с ТЭ. Мы стремились предоставить конкретные молекулярные механизмы участия TE в нейрон-специфичных процессах, когда это возможно; однако во многих случаях были доступны только феноменологические отчеты. Это подчеркивает важность дальнейших исследований в этой области.
-
Комбинированный эффект G-квадраплекса и нейроиндукторов как альтернативный подход к лечению глиабластомы человека
Перепрограммирование раковых клеток на основе лечения G-квадруплексом, обладающим антипролиферативной способностью, а также небольшими молекулами, способными превращать ИПСК в нейроны, может создать новый подход, позволяющий уменьшить вероятность рецидива глиобластомы и обойти резистентность опухоли к традиционной терапии. В этом исследовании мы проверили несколько комбинаций факторов, влияющих как на тотальные культуры клеток, полученные из опухолевой ткани пациентов после хирургической резекции, так и на две субфракции этой клеточной культуры после разделения их на CD133-обогащенные и CD133-истощенные популяции (предполагая, что CD133 быть маркером стволоподобных клеток глиобластомы). Клетки CD133+ и CD133- демонстрируют разные ответы на одни и те же комбинации факторов; Клетки CD133+ обладают стволоподобными свойствами и более устойчивы. Таким образом, способность воздействовать на клетки CD133+ дает возможность обойти резистентность к традиционной терапии и построить многообещающую стратегию трансляции для улучшения лечения пациентов с глиобластомой.
-
Нейровоспаление и утрата нейронов в гиппокампе связаны с непосредственными посттравматическими припадками и проявлением кортикостерона у крыс
Повреждение гиппокампа после черепно-мозговой травмы (ЧМТ) связано с поздними посттравматическими состояниями, такими как депрессия, снижение когнитивных функций и эпилепсия. Механизмы избирательного повреждения гиппокампа после ЧМТ недостаточно изучены. В этом исследовании, используя модель TBI у крыс (латеральное перкуссионное повреждение коры жидкости), мы оценили потенциальную связь немедленных посттравматических судорог и изменений уровня кортикостерона (CS) с нейровоспалением и потерей нейрональных клеток в гиппокампе. Показатели отдаленного повреждения гиппокампа (нейродегенерация и нейровоспаление) оценивали с помощью гистологического анализа (окрашивание по Нисслю, иммуногистохимическое окрашивание Iba-1) и ИФА (IL-1β и CS) через 1, 3, 7 и 14 дней после ЧМТ или ложной операции у самцов Вистар. крысы (n = 146). Уровень IL-1β был повышен только в ипсилатеральном гиппокампе на 1-й день после травмы. Пик CS был обнаружен на 3-й день в крови, ипсилатеральном и контралатеральном гиппокампе. Потеря нейрональных клеток в гиппокампе была продемонстрирована на двусторонней основе; в ипсилатеральном гиппокампе оно началось раньше, чем в контралатеральном. Активация микроглии была очевидна в гиппокампе с двух сторон на 7-й день после ЧМТ. Продолжительность приступов немедленного типа коррелировала с повышением уровня CS, уровнем IL-1β и потерей нейронов в гиппокампе. Эти данные свидетельствуют о потенциальной связи немедленных посттравматических припадков с CS-зависимым нейровоспалением, опосредованным отдаленным повреждением гиппокампа.
-
Эпигенетическая регуляция как основа долговременных изменений нервной системы: в поисках механизмов специфичности
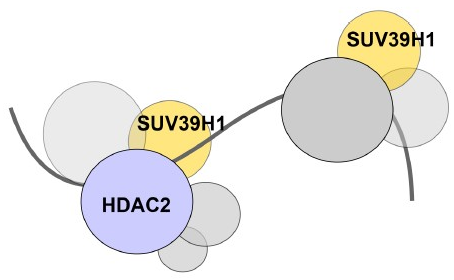
Адаптивные долговременные изменения в функционировании нервной системы (пластичность, память) не записываются в геноме, но напрямую связаны с изменениями экспрессии многих генов, составляющих эпигенетическую регуляцию. Обобщая известные данные о роли эпигенетики в регуляции пластичности и памяти, сотрудники Лаборатории клеточной нейробиологии обучения выделили несколько ключевых аспектов. (1) Различные комплексы ремоделирования хроматина и ДНК-метилтрансферазы могут быть организованы в многопротеиновые репрессорные комплексы высокого порядка, которые совместно действуют как «молекулярные тормозные колодки», избирательно ограничивая транскрипционную активность специфических генов в состоянии покоя. (2) Соответствующие физиологические стимулы вызывают каскад биохимических событий в активированных нейронах, приводящих к транслокации различных сигнальных молекул (протеинкиназ, NO-содержащих комплексов) в ядро. (3) Специфичное для стимула нитрозилирование и фосфорилирование различных эпигенетических факторов связано со снижением их ферментативной активности или изменениями внутриклеточной локализации, что приводит к временной дестабилизации репрессорных комплексов. (4) Устранение «молекулярных тормозов» открывает «критическое временное окно» для глобальных и локальных эпигенетических изменений, запускающих определенные транскрипционные программы и модуляцию эффективности синаптических связей. Можно предположить, что обратимые посттрансляционные модификации гистонов служат основой пластических изменений нейронной сети. С другой стороны, метилирование ДНК и зависящая от метилирования организация трехмерного хроматина могут служить стабильной молекулярной основой для долгосрочного поддержания пластических изменений и памяти.